细胞生物学方法
细胞生物学目前已经不再局限于单个基因/蛋白/细胞器的研究,而是利用系统的研究方法对基因/蛋白/细胞器网络进行研究。
细胞形态结构的观测方法
- 光学显微镜:照明系统采用可见光,使用玻璃透镜,可直接通过目镜观察镜像
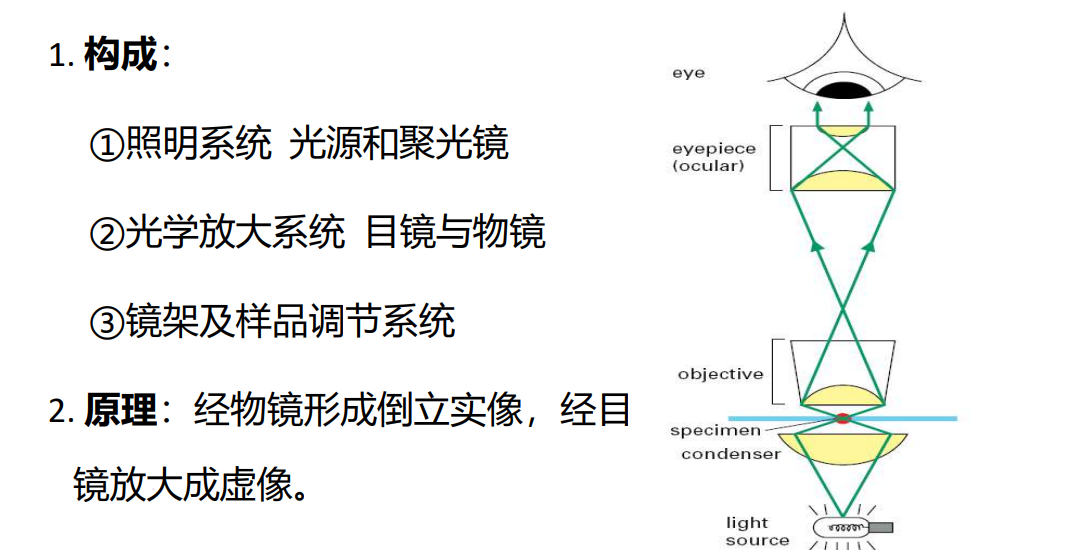
- 普通光学显微镜
- 细胞染色常用伊红-苏母金
- 相差显微镜(phase-contrast microscope)
- 作用:把透过标本的可见光的光程差和相位差,通过光的干涉转变成振幅差,从而提高了细胞不同密度的区域的对比度,使各种结构变得清晰可见。常用来观察未染色的细胞切片(相位板放置正确后细胞整体偏暗,轮廓偏亮)
- 微分干涉显微镜(differential interference microscope)
- 利用两组平面偏振光的干涉,加强影像的明暗效果,能显示结构的三维立体投影。标本可略厚一点,折射率差别更大,故影像的立体感更强。更适合研究活细胞。
- 荧光显微镜技术(fluorescence microscope)
- 光源为短波光(高压汞灯或氙灯);有两个特殊的滤光片(激发滤片、阻断滤片)细胞中有些物质,如叶绿素等,受紫外线照射后可发荧光;另有一些物质本身虽不能发荧光,但如果用荧光染料或荧光抗体染色后,经紫外线照射也可发荧光。荧光显微镜对这类物质进行定性或定量研究。灵敏度高,主要用于细胞结构和化学成分等的研究
- 激光共焦扫描显微镜技术(laser scanning confocal microscope)
- 用激光作光源,逐点、逐行、逐面快速扫描;能显示细胞样品的立体结构;分辨率是普通光学显微镜的3倍;比荧光显微镜提高1.4-1.7倍。
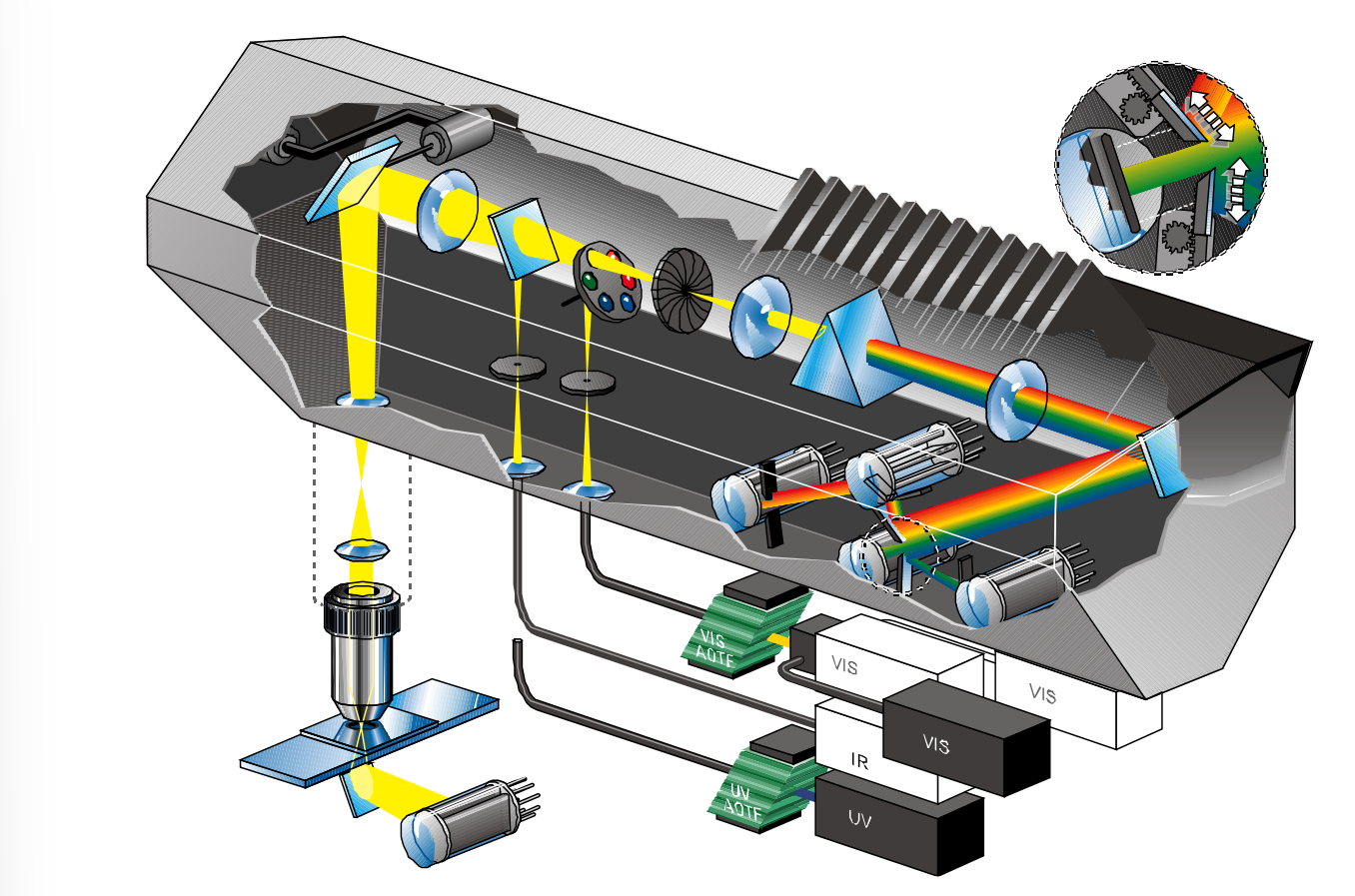
- 荧光共振能量转移技术(fluorescence resonance energy transfer, FRET)
- 双光子成像?
- 依赖于两个蛋白相互靠近
-
全内反射荧光成像(total internal reflection fluorescence microscope, TIRF)
- 普通光学显微镜
- 电子显微镜:照明系统采用电子束,通过光电转换设备观察样品的镜像。
- 电镜三维重构
- 低温电镜技术
- 超薄切片技术
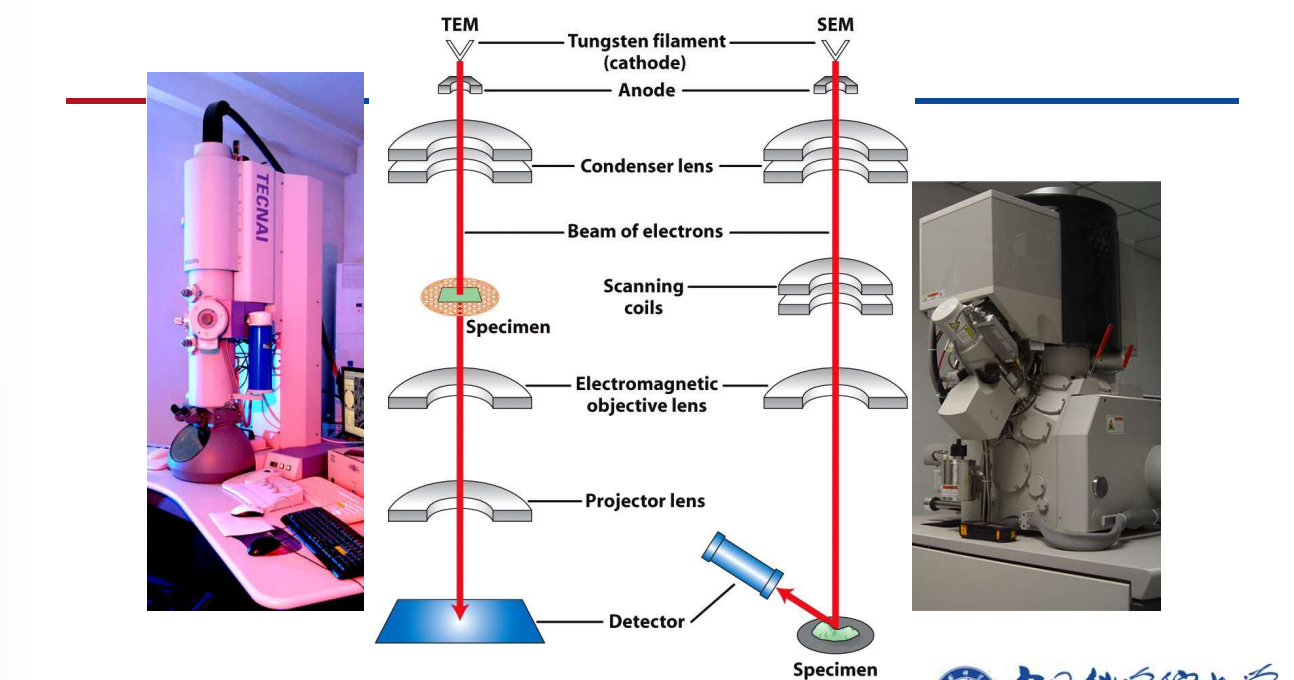
- 扫描电子显微镜(SEM)
- 主要得到细胞表面的形态结构
- 透射电子显微镜(TEM)
- 主要得到细胞内部结构
- 扫描电子显微镜(SEM)
细胞及其组分的分析方法
- 离心技术:是分离细胞器及各种大分子基本手段
- 高速离心机:转速10~25kr/min
- 超速离心机:转速>25kr/min(最高转速可达100000r/min)
- 差速离心:可将细胞器初步分离,常需进一步通过密度梯离心再行分离纯化。
- 特点:介质密度均一;速度由低向高,逐级离心。
- 常用来分离大小相差悬殊的细胞器或细胞
- 沉降顺序:核——线粒体——溶酶体与过氧化物酶体——内质网与高 尔基体——核糖体。
- 密度梯度离心:
- 原理:将要分离的细胞组分小心地铺放在含有逐渐增加的、高溶解性的惰性物质形成的密度梯度溶液表面,通过重力或离心力的作用使样品中不同组分以不同的沉降率沉降,形成不同的沉降带。各组分的沉降率与他们的形状和大小相关,通常以沉降系数(S值)表示。
- 常用介质:氯化铯、蔗糖。
- 免疫细胞化学
- 根据免疫学原理,利用抗体同特异性抗原专一结合,对抗原进行定位测定的技术。
- 抗原主要为大分子或与大分子结合的小分子;抗体则是由浆细胞针对特异的抗原分泌的γ球蛋白。如果将抗体结合上标记物,再与组织中的抗原发生反应,即可在光镜或电镜下显示出该抗原存在于组织中的部位。
- 胶体金技术:
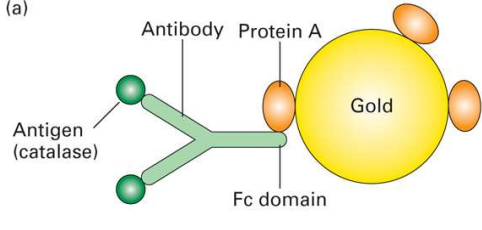
- 除了胶体金技术还有:
- 荧光素─免疫荧光技术(常用荧光素:异硫氰酸荧光素、罗丹明)
- 酶─酶标抗体法(常用的酶:辣根过氧化物酶、碱性磷酸酶)
- 放射性同位素标记—放射自显影
- 铁蛋白标记
- 分子杂交技术
- 流式细胞仪
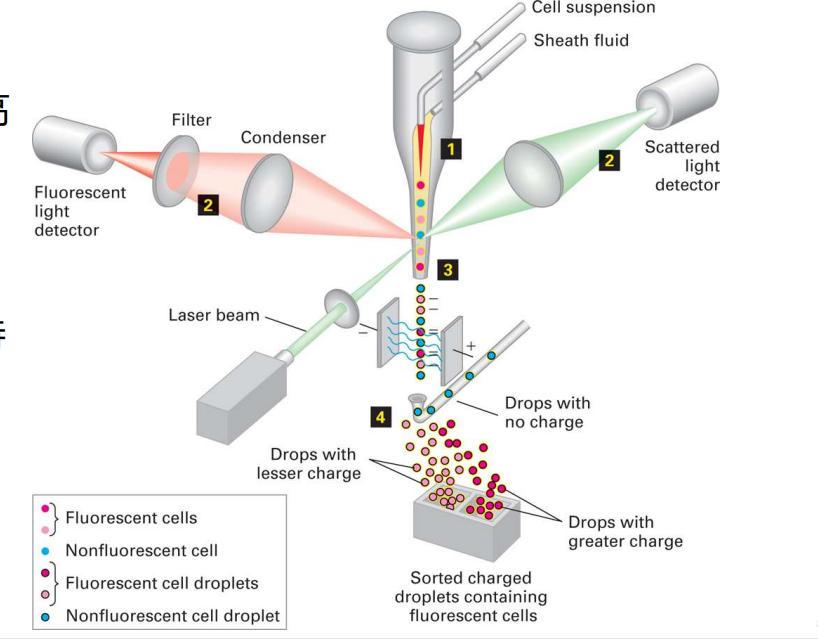
- 特点:单个细胞随液流高速运动
- 主要应用:
- 用于定量测定细胞中 的DNA、RNA或某些特定蛋白的含量;
- 测定细胞群体中具有特定性质细胞的数量;
- 从细胞群体中分离特异染色的细胞。
- 在免疫学中用于筛选细胞,十分重要!
细胞培养与细胞工程

植物细胞一般培养原生质体,但是难度较高,本课程一般不讨论。
疏水的蛋白(酯化修饰的蛋白)跑的快。
PCR:。。。
色谱:。。。
质谱:。。。
基因编辑/模式生物:。。。
组织特异性敲除:cre-loxP系统