Energy levels and spectra of alkali metals
碱金属的能级与光谱
原子实模型
对于非氢原子,其核外电子不仅受到核的吸引,还受到其他电子的斥力,当电子层数逐渐增加,内层电子还会对外层电子将核电荷屏蔽,使得电子实际收到的库仑力少于实际电荷间应产生的库仑力,这被称为内层电子的屏蔽效应;对应的,部分电子能够穿透内层电子的屏蔽靠近原子核,这被称为电子的钻穿效应。
原子实
我们通常以最外层电子作为研究对象,而除去外层电子以外的内层电子被称为原子实,由于泡利不相容原理,内层的电子通常都是两两成对的,它们共同占据着一个能级中的一个轨道,且自旋相反,同时内层电子各个角动量方向的各个轨道都被填满,因此原子实的总角动量为零。
有效核电荷
由于原子实的屏蔽效应的存在,对于外层电子来说有效核电荷不在等于实际电荷,而是偏小,对于碱金属:
碱金属
碱金属在元素周期表中于氢同族,都是最外层仅有一个电子。他们具有相似的化学性质,其光谱公式也相仿:当n很大时两者的能级很接近,当n很小时,两者的能级差别较大[1],我们设想:碱金属的光谱也是由于单电子的活动产生的。
原子实极化与钻穿效应
通常情况下价电子在n很大的轨道上运动时,价电子与原子实间的作用很弱,原子实电荷对称分布,正负电荷中心重合在一起。然而,类似地球的潮汐现象,最外层电子与原子实的相互作用可能使原子实极化,整个原子系统形成一个电偶极子,而电偶极矩的方向总是指向价电子(大量的负电荷受排斥作用汇聚在相反的反方向)。价电子的势能为:
第一项为库伦势,第二项为电偶极矩产生的能量。
对于不同的 l,有不同的电子云分布,分别相应于不同的“轨道”,对于 l 较小的轨道[2],电子有可能进入原子实发生轨道贯穿。
未发生轨道贯穿时,原子实的有效电荷数是1,原子的能级与氢原子能级很接近。价电子处在轨道贯穿时,原子实的有效电荷数大于1,导致其能量较氢原子小,即相应的能级降低。
价电子能量
对于同一能层[3],不同的l有以下关系:l越小,越容易贯穿内层电子,从而有效核电荷数越大,从而能量越低。[4]
综上,原⼦实极化和价电⼦的轨道贯穿,使得碱⾦属原⼦能级分裂,且都使得能量下降;⼩l,能级下降⾮常明显.
碱金属的能级与光谱项
每个线系的每一条光谱线的波数都可以表示为两个光谱项之差,类似里德伯公式我们可以有:
右边第一项为基态项,第二项为激发态项,然而
综上同理:
碱金属原子光谱的实验规律
与氢原子不同,主要分为4个大类的线系:
- 主线系:
- 第一辅线系(漫线系):
- 第二辅线系(锐线系):
- 伯格曼系(基线系):
n显然不小于终态的主量子数。
如图所示,锂原子与氢原子的能级图如下:
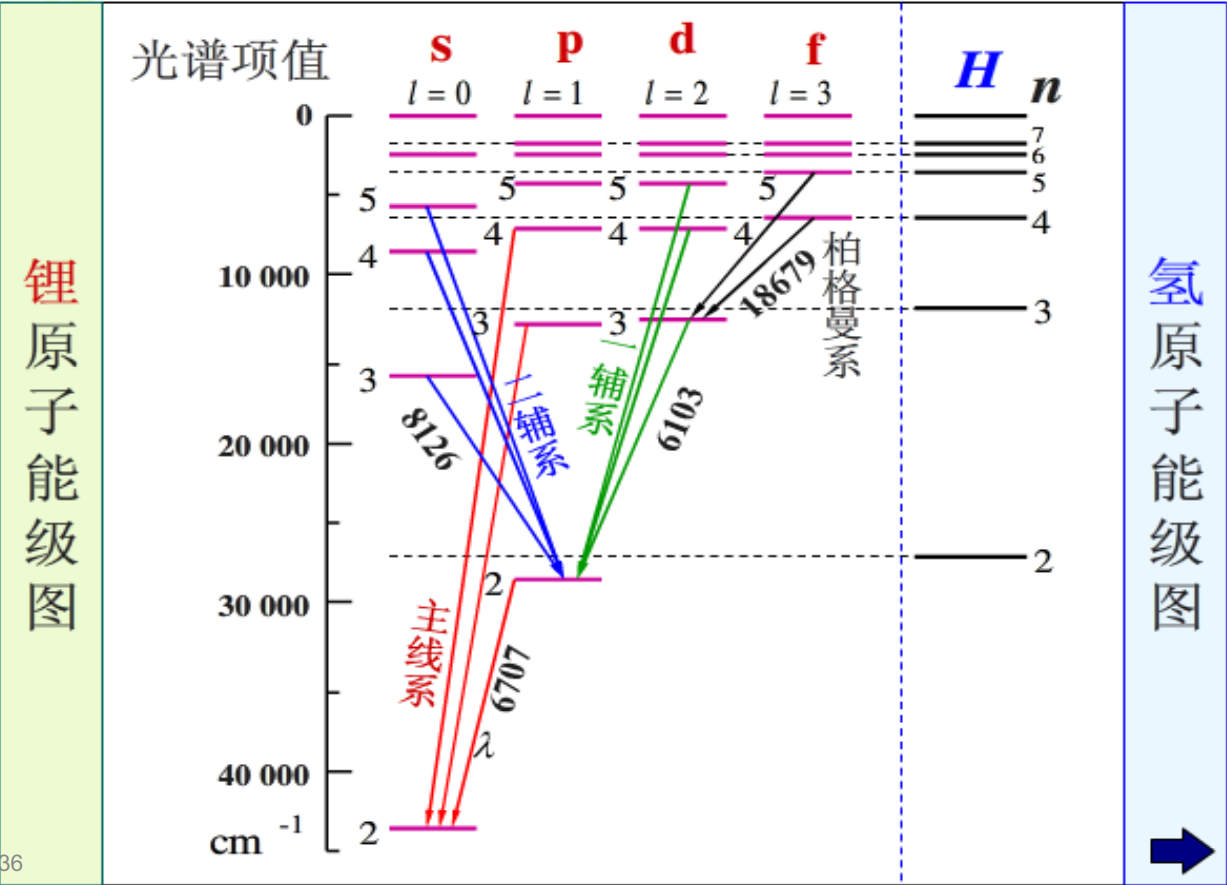
观察此图,可以发现以下锂原子光谱图特点: - 能量由(n, l)两个量子数决定,n相同, l 不同的能级不相同。
- n相同时能级的间隔随 l 的增大而减小,l相同时,能级 的间隔随 n 的增大而减小。
- n很大时,能级与氢的很接近,少数光谱线的波数几乎 与氢的相同;当n很小时,谱线与氢的差别较大。
碱金属光谱的精细结构
由实验可知,所有碱金属原子的光谱都有相仿的精细结构。在高分辨率光谱仪下观察可以发现主线系、锐线系都是双线结构;锐线系、基线系都是三线结构。
类比氢原子,我们认为碱金属的精细结构来源于三部分:
- 轨道贯穿引起的能级下移
- 自旋轨道相互作用(主要)引起的能级裂分
- 动能势能的相对论修正引起的能级位移。[5]
其中
粗结构:能量的数量级为
精细结构:能量的数量级为